2022年2月28日
理化学研究所
東北大学
兵庫県立大学
京都大学
高輝度光科学研究センター
東京大学
-XFELが捉えた光駆動型イオンポンプロドプシンの構造変化-
理化学研究所(理研)生命機能科学研究センタータンパク質機能・構造研究チームの白水美香子チームリーダー、保坂俊彰技師、放射光科学研究センター分子動画研究チームの南後恵理子チームリーダー(東北大学多元物質科学研究所教授)、同SACLA利用技術開拓グループ岩田想グループディレクター(京都大学大学院医学研究科教授)、兵庫県立大学大学院理学研究科の久保稔教授、高輝度光科学研究センターXFEL利用研究推進室の登野健介主席研究員、東京大学大学院理学系研究科の濡木理教授、東京大学大気海洋研究所附属地球表層圏変動研究センターの吉澤晋准教授らの共同研究グループは、太陽光などの光を受けて塩化物イオン(Cl-)を細胞内に輸送する海洋細菌由来の「光駆動型イオンポンプロドプシン[1]」の構造変化を、X線自由電子レーザー(XFEL)[2]施設「SACLA[3]」を用いた高解像度の構造解析により解明しました。
本研究成果は、光駆動型イオンポンプロドプシンのイオン輸送の仕組みを理解する上で重要な知見であり、光を使って神経細胞機能などを操作する光遺伝学(オプトジェネティクス)[4]のさらなる改良への応用が期待できます。
海洋細菌Nonlabens marinusが持つ光駆動型イオンポンプロドプシンNM-R3[5]は、細胞内部に向かって塩化物イオンを輸送する機能を持ちます。
今回、共同研究グループは「SACLA」を用いた「時分割結晶構造解析[6]」により、光照射に伴うNM-R3の構造変化を詳細に捉えることに成功しました。この結果からNM-R3が塩化物イオンを輸送するメカニズムと輸送経路を明らかにするとともに、イオンの逆流や過流入を防ぐ巧妙な仕掛けがあることを見いだしました。
本研究は、科学雑誌『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』オンライン版(2月23日付)に掲載されました。
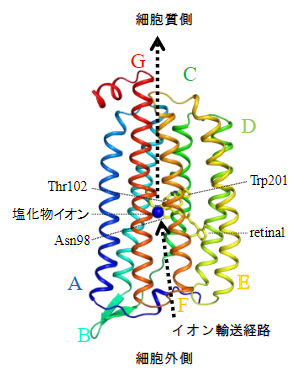
光駆動型イオンポンプロドプシンNM-R3の立体構造(青丸は輸送中の塩化物イオン)
背景
海洋細菌の細胞膜には、海水中の主なイオンである水素イオン(プロトン、H+)、ナトリウムイオン(Na+)、塩化物イオン(Cl-)の取り込みと排出を行う仕組みが備わっています。この機能を担うのは「光駆動型イオンポンプロドプシン」と呼ばれる膜タンパク質であり、光が当たるとイオンを細胞の内外に輸送する光駆動型のポンプとして働きます。
光駆動型イオンポンプロドプシンには上記3種類のイオンそれぞれに対応したタイプがありますが、輸送するイオン種にかかわらず、共通の構造をとっています。膜を貫通する7本のα-ヘリックス[7]で構成され、7番目のヘリックスに光を吸収する分子レチナールが共有結合しています。レチナールは光を受けると構造が変化して、タンパク質全体が構造変化を起こす引き金となり、この結果、膜を通過する経路が開かれてイオンが輸送されます。
この過程はミリ秒(ms、1msは1,000分の1秒)の単位で起こる非常に速い反応であり、この光応答を応用した技術が「光遺伝学(オプトジェネティクス)」です。光遺伝学は神経細胞などに光駆動型イオンポンプロドプシンを発現させ、光照射により特定の細胞機能を制御します。高い時間精度で神経活動を操作できることから、神経科学の重要なツールとなっています。
近年開発されたX線結晶構造解析法の一種である「時分割結晶構造解析法」では、タンパク質の微細な動きを高い時間分解能で観察できます。この手法により、現在までに、水素イオンやナトリウムイオンなどの陽イオンを細胞外に排出する機能を持つ光駆動型イオンポンプロドプシンについて、光照射に伴う詳細な構造変化が明らかにされています。一方、塩化物イオンのような陰イオンを細胞内に取り込むものについての時分割結晶構造解析はまだ行われていませんでした。
海洋細菌Nonlabens marinusが持つ微生物型ロドプシン「NM-R3」は、光を受容すると陰イオンである塩化物イオンを一つだけ細胞外から細胞内に輸送します。さらに、同じ陰イオンである臭化物イオン(Br-)やヨウ化物イオン(I-)も同様に取り込むことができます。臭素(Br)やヨウ素(I)は塩素(Cl)よりも原子番号が大きく、X線結晶構造解析においてその位置を特定しやすいなどの利点があります。NM-R3の立体構造は2016年に保坂俊彰技師らが報告していますが注)、陰イオン輸送機構の詳細については不明な点が多く残っていました。そこで本研究では、塩化物イオンを輸送する光駆動型イオンポンプロドプシンの構造変化を明らかにするため、NM-R3を対象に時分割結晶構造解析を行いました。
- 注)Hosaka T, et al. (2016) Structural Mechanism for Light-driven Transport by a New Type of Chloride Ion Pump, Nonlabens marinus Rhodopsin-3. J Biol Chem 291(34):17488-17495.
研究手法と成果
共同研究グループは、大腸菌無細胞合成系[8]からNM-R3を合成し、塩化物イオンの代わりに臭化物イオンやヨウ化物イオンを含む溶液を用いて精製、そこから大量の微結晶をLCP法[9]によって調製しました。この微結晶に光を照射したところ、照射後マイクロ秒(μs、1μsは100万分の1秒)からmsの時間単位で光の吸収率が変化する現象が見られたことから、結晶中でもNM-R3の構造変化を伴うイオン輸送機構が働くことが分かりました。
そこで次に、X線自由電子レーザー(XFEL)施設「SACLA」を用いて時分割結晶構造解析を行うため、臭化物イオンを入れて精製したNM-R3の微結晶に波長540ナノメートル(nm、1nmは10億分の1メートル)の緑色レーザー光を照射し、1ms後のデータを収集しました。構造解析の結果、図1に示すように、レチナールの構造変化が引き金となり、複数のα-ヘリックスが協調して動くことで、細胞質側にイオンの通る空間が形成され、同時に、細胞外側ではイオンの逆流や過流入を防ぐような構造変化を観測しました。
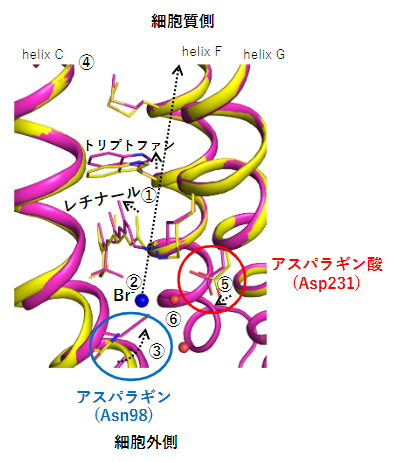
図1 時分割結晶構造解析が捉えた臭化物イオンに対するNM-R3のレチナール周辺構造の変化
NM-R3を構成する7本のα-ヘリックスのうち、3番目(helix C)、6番目(helix F)、7番目(helix G)の膜貫通ヘリックスを示す。変化前の構造を黄色、変化後をピンクで表示し、各分子の移動先を点線の矢印で表示した。観察された構造変化は以下のようにまとめられ、数字は図中の破線矢印や空間と対応する。赤球は、臭化物イオン(Br-)の動きに関与する水分子を示す。
- ①緑色レーザー光照射により構造変化したレチナールが細胞質側に向かって動き、6番目の膜貫通ヘリックス(helix F)に存在するトリプトファン残基を押し上げる。
- ②①のレチナールの構造変化に伴い、レチナールと相互作用していた臭化物イオンがレチナールから離れる。
- ③②により空いた空間には、臭化物イオンと相互作用していた3番目の膜貫通ヘリックス(helix C)に存在している98番目のアスパラギン(Asn98)が大きく動いて配置される。
- ④③の動きにつれて、helix C全体が大きく動き、細胞質側にイオンが通る空間が形成される(図2も参照)。
- ⑤さらに、helix Cのアスパラギン(Asn98)の対面に位置する7番目の膜貫通ヘリックス(helix G)のアスパラギン酸(Asp231)が、①の動きに伴うhelix Gの構造変化により、アスパラギン(Asn98)に向かって動く。
結果として、Asn98とAsp231の二つのアミノ酸残基が、臭化物イオンがもともと存在していた空間を埋めるように移動することによって、イオン輸送経路を閉じる役割を果たす。これらの構造変化は、イオンの逆流や過流入を防ぐ働きをしていると考えられる。
続いて、ヨウ化物イオンを用いて精製したNM-R3の微結晶を用いて、同様に時分割結晶構造解析を行いました。ヨウ化物イオンは異常分散[10]効果により、その位置を臭化物イオンよりも同定しやすい性質があります。この性質を利用し、光照射後10μsと、1msにおける輸送されたヨウ化物イオンの位置の同定を試みました。解析の結果、10μs後にヨウ化物イオンは、helix Cに存在している細胞質側の102番目のスレオニン(Thr102)付近に移動することが明らかになりました。一方、1ms後には、ヨウ化物イオンの結合位置は見られず既に排出されていることや、ヨウ化物イオン排出口に近い細胞質側のhelix C、helix F、helix Gの周辺に、ヨウ化物イオンが輸送される経路が存在することが示唆されました。
実際の生理的環境では、ヨウ化物イオンではなく塩化物イオンが輸送されることから、NM-R3の構造変化は、細胞質側の出口付近の輸送経路を広げるのと同時に、入口付近の塩化物イオン結合部位にある輸送経路を一時的に閉じることで、輸送反応中に塩化物イオンを一つだけ輸送するという精密な機構であることが示されました(図2)。
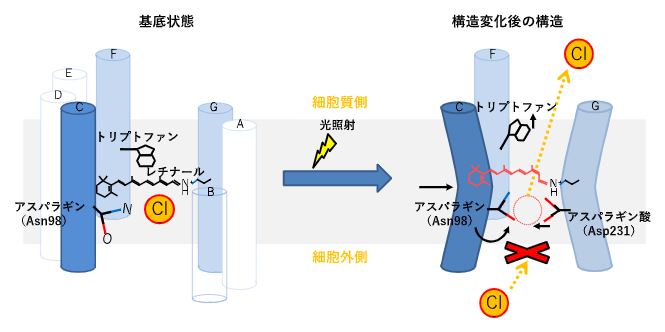
図2 NM-R3における構造変化のモデル図
- (左)構造変化前の基底状態の7本のα-ヘリックスを円柱で表記した。
- (右)構造変化後の模式図、構造変化が起こる3本の膜貫通ヘリックスのみを表示した。レチナールは左図の黒線で示す伸びた構造(all-trans状態)から、赤線で示す一部が折れた(異性化された13-cis/15-syn型)になっていた。各アミノ酸の動きは矢印で表示した。本研究では、臭化物イオンとヨウ化物イオンを用いて解析を行ったが、生理的環境では塩化物イオン(Cl-)が細胞外から細胞室側に輸送される。
今後の期待
光駆動性のイオンポンプである微生物型ロドプシンは、新しい機能を持つものが現在も次々に見つかっており、一部は神経科学研究における光遺伝学のツールとして応用されています。本研究で明らかになった構造変化の詳細な知見は、光遺伝学ツールの改良につながると期待できます。
補足説明
- 1.光駆動型イオンポンプロドプシン
レチナールを発色団として持つ膜タンパク質であり、光が当たるとイオンを細胞の内外に輸送する機能を持つ。水素イオンやナトリウムイオンなどの陽イオンを細胞外に排出するバクテリオロドプシンやKrokinobacter rhodopsin 2(KR2)、塩化物イオンを細胞内に輸送するハロロドプシンなどがある。当初、光駆動型イオンポンプロドプシンを持つ微生物は高塩濃度に適応した細菌に特有のものと見られていたが、近年、多くの海洋細菌がこの遺伝子を持つと考えられている。
- 2.X線自由電子レーザー(XFEL)
既存の放射光施設で用いられるX線と比べて非常に高輝度で位相のそろった、数フェムト秒(1フェムト秒は1,000兆分の1秒)のX線パルスレーザー。短時間で回折測定を行うことができるため、測定時に通常の放射光施設での測定では回避ができないX線による損傷がない構造を見られることに加えて、時分割結晶構造解析のような測定にも用いられる。XFELはX-ray Free Electron Laserの略。
- 3.SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本で初めてのXFEL施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free-electron LAserの頭文字を取ってSACLAと命名された。2011年6月に最初のX線レーザーを発振、2012年3月から供用運転が開始され、利用実験が始まった。大きさが諸外国の同様の施設と比べて数分の1とコンパクトであるにも関わらず、0.1ナノメートル(nm、100億分の1メートル)以下という短波長のレーザー光の生成能力を有する。
- 4.光遺伝学(オプトジェネティクス)
光感受性のイオンチャンネルや酵素を細胞内に発現させ、それらの機能や形態形成などを光で制御する技術。微生物型ロドプシンによる神経細胞の活動電位制御などが行われている。
- 5.NM-R3
塩化物イオンを細胞内に輸送するタンパク質。タンパク質内部に光に反応する発色団であるレチナールを持つ。NM-R3はNonlabens marinus rhodopsin-3の略。
- 6.時分割結晶構造解析
結晶中の分子の微細な動きを高い時間分解能で観察する手法。本研究では、室温で微結晶を連続的にX線自由電子レーザーのX線照射ポイントまで流し、これに構造変化を引き起こす緑色レーザー光を照射する装置を組み合わせてデータを取ることで、光駆動性イオンポンプロドプシンにおける構造変化を観察した。Time-resolved serial femtosecond crystallography(TR-SFX)法の訳語。
- 7.α-ヘリックス
タンパク質の二次構造の一つ。ポリペプチド鎖が右巻きのらせん構造をとり、アミノ基とカルボキシル基の間の水素結合によって安定化されている。
- 8.大腸菌無細胞合成系
生きた大腸菌を使用せず、代わりに大腸菌細胞内に存在する酵素や基質などを利用してタンパク質を合成する方法。転写(DNAからmRNA合成する段階)と翻訳(mRNAからタンパク質を合成する段階)を同時進行する方法と、翻訳のみを行う方法がある。
- 9.LCP法
膜タンパク質の結晶を作製する方法の一つ。膜タンパク質をキュービック相などの脂質と水溶液の混合状態で結晶化させる。細胞膜に類似した脂質二重膜環境で膜タンパク質の結晶化が進行する。LCPはlipidic cubic phaseの略。
- 10.異常分散
結晶内原子の内核電子を励起する波長付近のX線を照射したときに起こる特殊な散乱現象。
共同研究グループ
理化学研究所
生命機能科学研究センター
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
技師 保坂 俊彰(ほさか としあき)
研究員 伊原 健太郎(いはら けんたろう)
技師 桂 一茂(かつら かずしげ)
技師 赤坂 領吾(あかさか りょうご)
専任研究員 久野 玉雄(ひさの たまお)
上級研究員(研究当時) 染谷 友美(そめや ともみ)
転写制御構造生物学研究チーム
チームリーダー 関根 俊一(せきね しゅんいち)
研究員 江原 晴彦(えはら はるひこ)
翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(いとう たくひろ)
研究員 柏木 一宏(かしわぎ かずひろ)
放射光科学研究センター
SACLA利用技術開拓グループ
グループディレクター 岩田 想(いわた そう)
(京都大学大学院医学研究科教授)
客員研究員 田中 里枝(たなか りえ)
客員技師(研究当時) 田中 智之(たなか ともゆき)
客員研究員 ルオ・ファンジア(Luo Fangjia)
客員技師(研究当時) 有馬 登志(ありま とし)
客員技師(研究当時) 山下 鮎美(やました あゆみ)
分子動画研究チーム
チームリーダー 南後 恵理子(なんご えりこ)
(東北大学多元物質科学研究所教授)
生体機構研究グループ
先任研究員 内藤 久志(ないとう ひさし)
生物試料基盤グループ(研究当時)
リサーチアソシエート(研究当時) 松浦 祥悟(まつうら よしのり)
ビームライン研究開発グループ
技師 菅原 道泰(すがはら みちひろ)
イメージング開発チーム
特別研究員(研究当時) 野村 高志(のむら たかし)
高輝度光科学研究センター XFEL利用研究推進室
先端光源利用研究グループ
主席研究員 登野 健介(との けんすけ)
研究員 大和田 成起(おおわだ しげき)
東北大学 大学院医工学研究科 医工学専攻
計測・診断医工学講座 分子構造解析医工学分野
准教授 村山 和隆(むらやま かずたか)
兵庫県立大学 大学院理学研究科
教授 久保 稔(くぼ みのる)
東京大学
大学院理学系研究科 生物科学専攻
教授 濡木 理(ぬれき おさむ)
特任助教(研究当時) 中根 崇智(なかね たかのり)
大気海洋研究所 附属地球表層圏変動研究センター 生物遺伝子変動分野
准教授 吉澤 晋(よしざわ すすむ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、動的構造生物学)で実施し、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「クロライドポンプNM-R3イオン輸送機構の解明と時分割シリアルフェムト秒構造解析(研究代表者:保坂俊彰)」、同新学術領域研究(研究領域提案型)「大腸菌無細胞合成系を利用した時分割SFX実験に適したサンプル調製法の開発(研究代表者:保坂俊彰)」、同新学術領域研究(研究領域提案型)「時間分解構造解析を補完する精密顕微分光計測(研究代表者:久保稔)」、同新学術領域研究(研究領域提案型)「高速分子動画法によるタンパク質非平衡状態構造解析と分子制御への応用(研究代表者:岩田想)」、同基盤研究(B)「X線自由電子レーザーによるGタンパク質共役型受容体の活性化機構の解明(研究代表者:南後恵理子)」、同基盤研究(B)「光駆動型イオンポンプの分子動画解析とその応用(研究代表者:南後恵理子)」、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(SPring-8/SACLAにおけるタンパク質立体構造解析の支援および高度化)(研究代表者:山本雅貴)」による支援を受けて行われました。
原論文情報
- Toshiaki Hosaka, Takashi Nomura, Minoru Kubo, Takanori Nakane, Luo Fangjia, Shun-ichi Sekine, Takuhiro Ito, Kazutaka Murayama, Kentaro Ihara, Haruhiko Ehara, Kazuhiro Kashiwagi, Kazushige Katsura, Ryogo Akasaka, Tamao Hisano, Tomoyuki Tanaka, Rie Tanaka, Toshi Arima, Ayumi Yamashita, Michihiro Sugahara, Hisashi Naitow, Yoshinori Matsuura, Susumu Yoshizawa, Kensuke Tono, Shigeki Owada, Osamu Nureki, Tomomi Kimura-Someya, So Iwata, Eriko Nango, and Mikako Shirouzu, "Conformational alterations in unidirectional ion transport of a light-driven chloride pump revealed using X-ray free electron lasers", Proceedings of the National Academy of Sciences of the United States of America(PNAS), 10.1073/pnas.2117433119
発表者
理化学研究所
生命機能科学研究センター タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
技師 保坂 俊彰(ほさか としあき)
放射光科学研究センター
分子動画研究チーム
チームリーダー 南後 恵理子(なんご えりこ)
(東北大学多元物質科学研究所教授)
SACLA利用技術開拓グループ
グループディレクター 岩田 想(いわた そう)
(京都大学大学院医学研究科教授)
兵庫県立大学 大学院理学研究科
教授 久保 稔(くぼ みのる)
高輝度光科学研究センター XFEL利用研究推進室
主席研究員 登野 健介(との けんすけ)
東京大学
大学院理学系研究科
教授 濡木 理(ぬれき おさむ)
大気海洋研究所 附属地球表層圏変動研究センター
准教授 吉澤 晋(よしざわ すすむ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198
Email: press.tagen [at] grp.tohoku.ac.jp
兵庫県立大学 播磨理学キャンパス 経営部総務課
Tel: 0791-58-0101 / Fax: 0791-58-0131
Email: soumu_harima [at] ofc.u-hyogo.ac.jp
京都大学 総務部広報課国際広報室
Tel: 075-753-5729
Email: comms [at] mail2.adm.kyoto-u.ac.jp
高輝度光科学研究センター 利用推進部 普及情報課
Tel: 0791-58-2785 / Fax: 0791-58-2786
Email: kouhou [at] spring8.or.jp
東京大学 大学院理学系研究科・理学部 広報室
Tel: 03-5841-8856 / Fax: 03-5841-1035
Email: kouhou.s [at] gs.mail.u-tokyo.ac.jp
東京大学 大気海洋研究所 広報室
Email: kouhou [at] aori.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。
産業利用に関するお問い合わせ
お問い合わせフォーム
Adblock test (Why?)
"輸送" - Google ニュース
February 28, 2022 at 12:08PM
https://ift.tt/M8o09Yc
光でイオンを輸送する膜タンパク質の巧妙な仕組み - 理化学研究所
"輸送" - Google ニュース
https://ift.tt/TAQ2vPy
Shoes Man Tutorial
Pos News Update
Meme Update
Korean Entertainment News
Japan News Update


























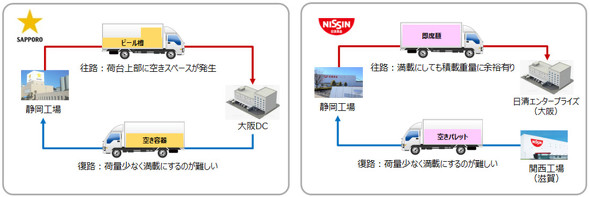
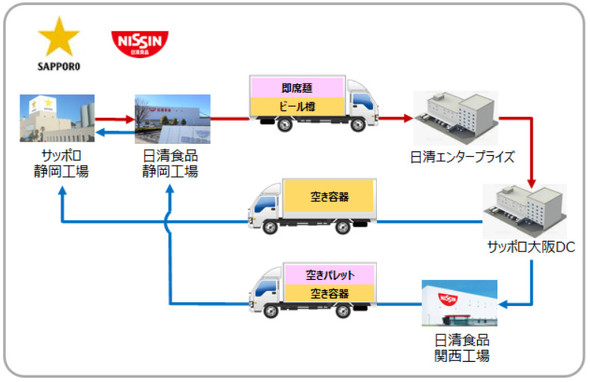
 重いビールと軽い即席麺での共同物流を実施[クリックで拡大] 出所:サッポロホールディングス
重いビールと軽い即席麺での共同物流を実施[クリックで拡大] 出所:サッポロホールディングス